蛋白质变构现象在自然界中广泛存在,能够调节蛋白质的折叠、组装和功能,在生物识别、信号转导、跨膜分子机器和药物发现中发挥重要作用。为了模拟天然变构蛋白,已经开发了多种多肽和拟肽聚合物,通过构象转变来调节自组装结构和功能。大多数研究通过调控侧链库仑、疏水和氢键相互作用实现了无序与有序二级结构(β-折叠或α-螺旋)之间的构象变化。但在合成聚合物中探索二级构象的有序转变仍然是一项具有挑战性的任务。此外,聚合物体系中的构象变化主要由内源性刺激(pH,氧化还原、酶等)引发,其在生物医学领域的应用因内源性刺激水平低和动态变化性质以及有效反应的时空障碍而受到限制。
近日,公司丁明明教授团队以“Photoallosteric Polymersomes toward On-Demand Drug Delivery and Multimodal Cancer Immunotherapy”为题在Advanced Materials上报道了一种由两亲性聚半胱氨酸自组装形成的光控变构囊泡。在前期工作中,该研究团队建立了氧化门控和金属配位化学调控聚氨基酸二级构象的新方法,揭示非肽高分子有序二级构象形成和转变机制,并通过构象有序转变驱动胶束-囊泡转变、调控聚合物囊泡尺寸和膜通透性(J. Am. Chem. Soc. 2018, 140, 6604-6610; Angew. Chem. Int. Ed. 2021, 60, 22529–22536;Nat. Commun.2022, 13, 4551;Angew. Chem. Int. Ed. 2023, 62, e202213000)。在此基础上,研究人员结合近红外光敏分子构建了新型光控变构囊泡。在近红外光照射下,该聚合物能快速从β折叠转变为α螺旋构象,其转变速度是高浓度活性氧条件下的200倍。这种超快变构行为能够有效增强纳米囊泡的入胞、溶酶体逃逸和按需释药性能,从而可在体内消除肿瘤,并产生良好的免疫记忆,避免了肿瘤的转移和复发。
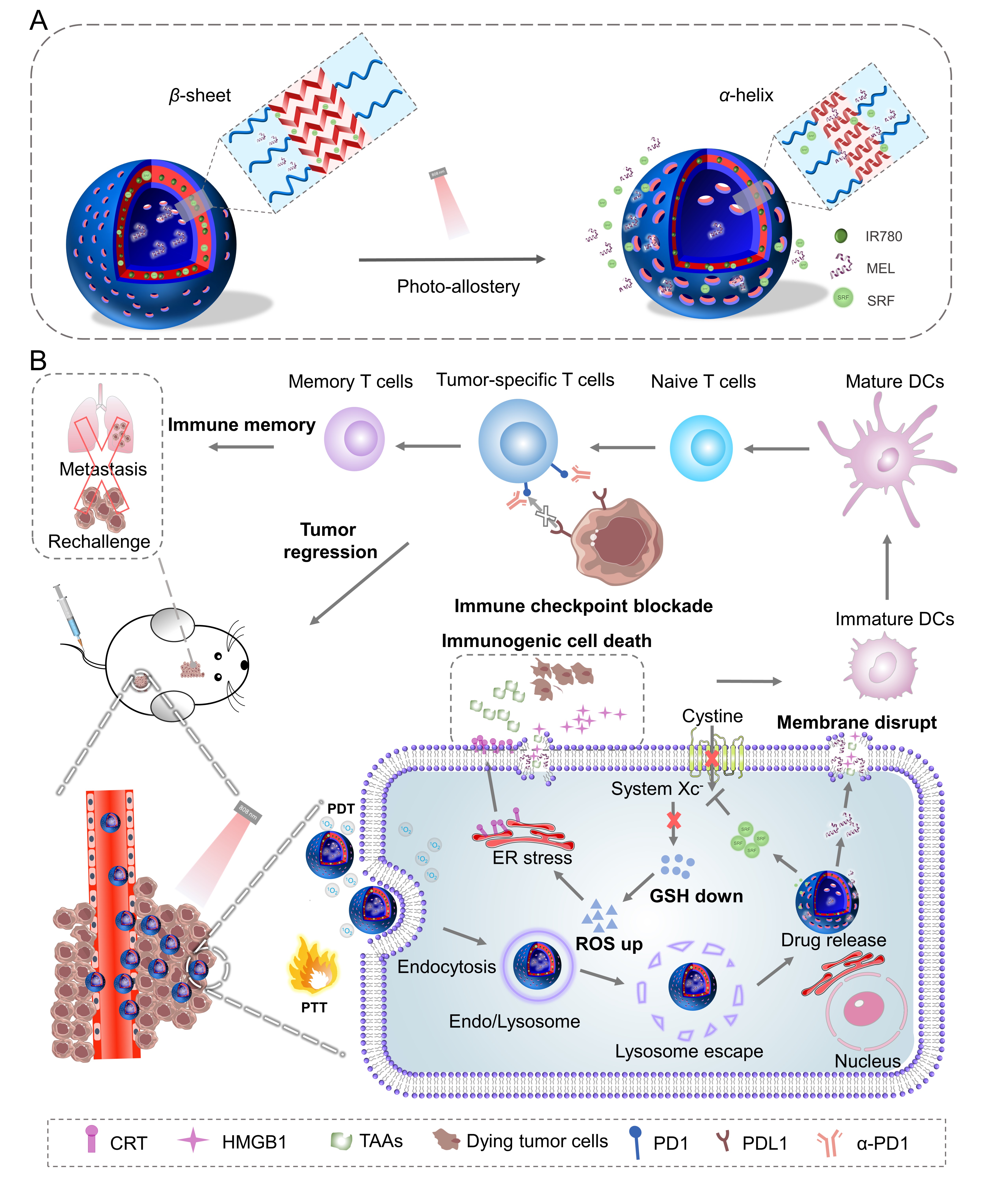
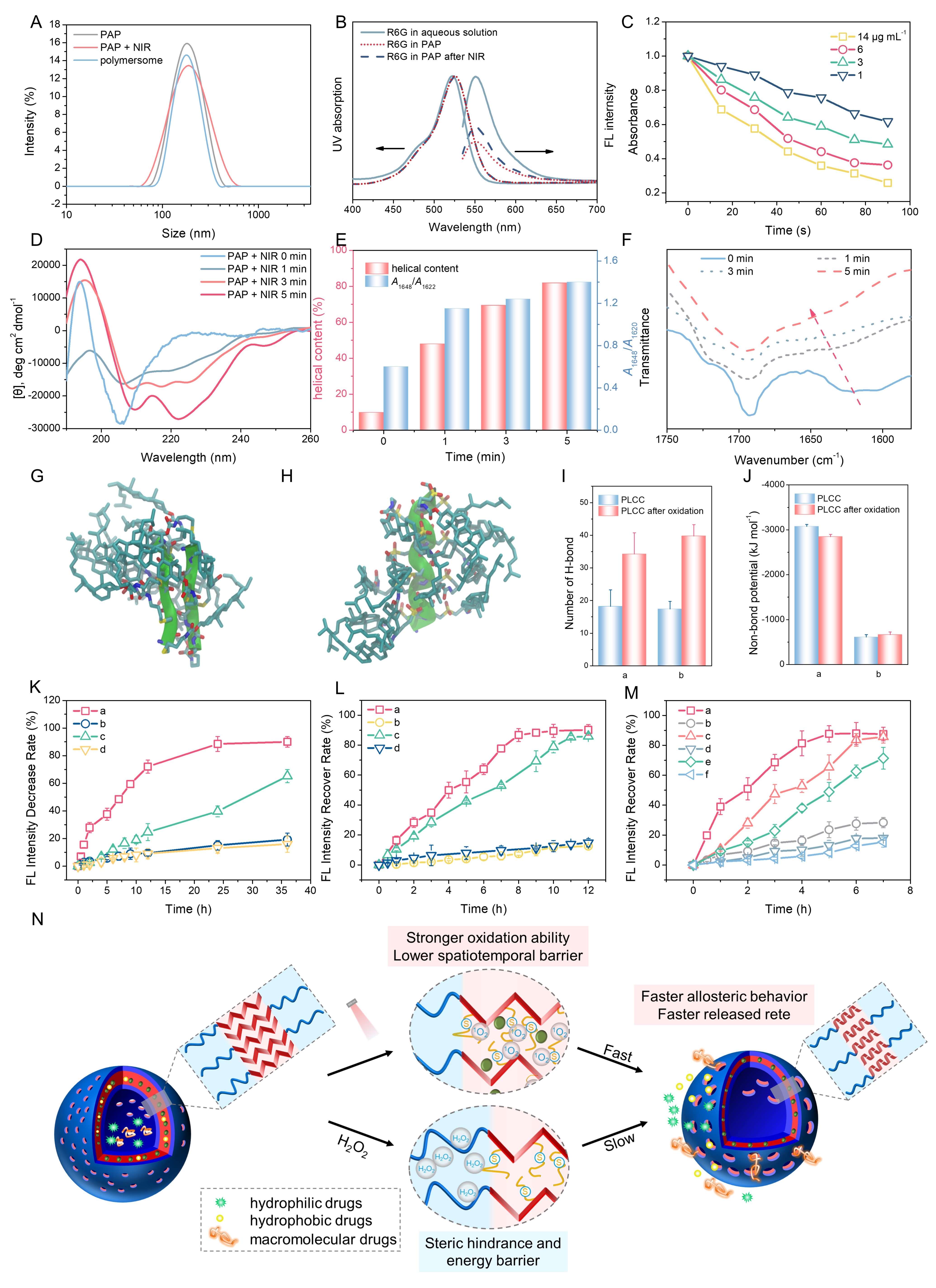
研究者通过将近红外光敏分子IR780与聚乙二醇-聚半胱氨酸结合,构建了光控变构囊泡。其在光照条件下能够在原位产生单线态氧,使聚合物构象在5min内从β折叠转变为α螺旋,作者通过分子动力学模拟揭示了聚氨基酸构象有序转变的分子机制。光响应变构行为在保证囊泡完整性的前提下提高了囊泡膜通透性,重构膜结构,从而促进不同分子量的亲水和疏水性药物的响应性释放,且释放速率明显高于氧化响应释放。
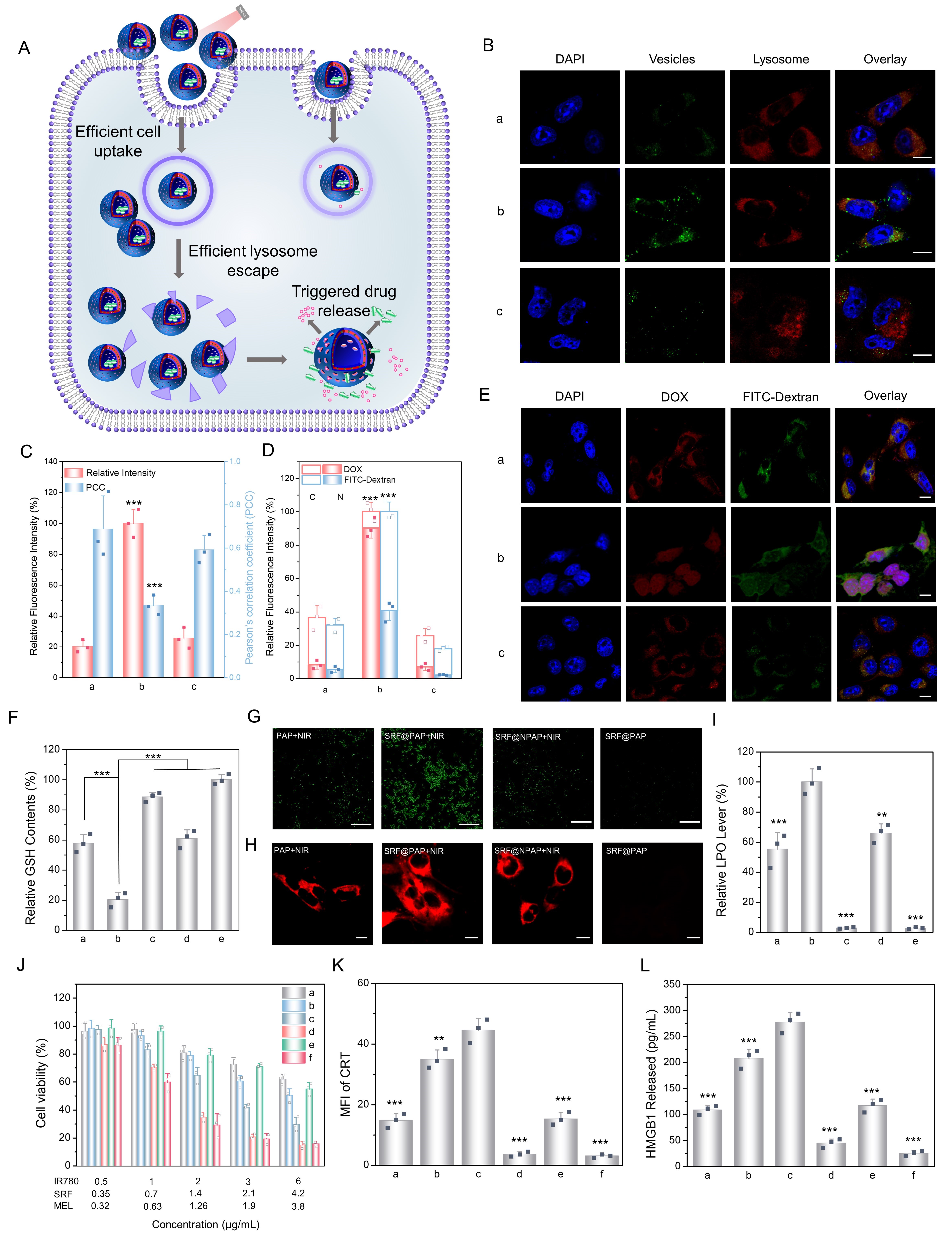
光控变构囊泡的超快构象转变增强了纳米载体的膜活性,使其具有优异的入胞及溶酶体逃逸能力,并实现GSH抑制剂索拉菲尼(SRF)和毒性多肽药物蜂毒肽(MEL)的高效递送,从而有效破坏细胞膜和提高胞内活性氧浓度,成功诱导免疫原性细胞死亡(ICD),表现出良好的肿瘤细胞杀伤效果。
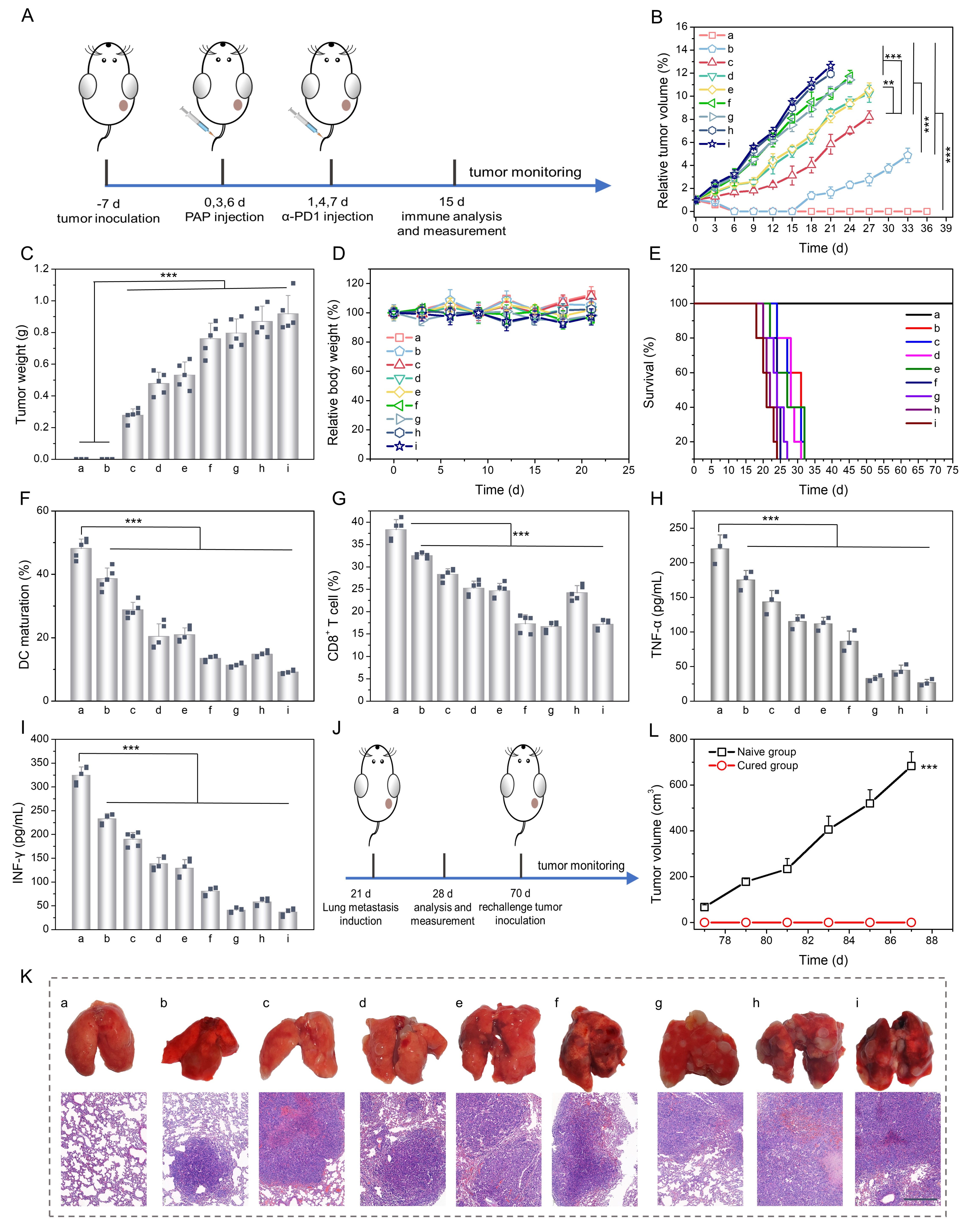
研究团队进一步将载有SRF和MEL的光控变构囊泡用于小鼠的肿瘤治疗,并与免疫阻断法相结合,成功激活小鼠体内免疫效应,重塑免疫微环境,在体内实现优异的协同抗肿瘤效果,清除了肿瘤,且有效抑制了肿瘤的转移和复发。该光控变构策略为高分子多级组装结构和功能调控以及智能响应药物递送系统的设计提供了新的思路,并且提供了一种具有构象功能开关的仿生纳米材料,在药物递送、疾病诊断和治疗方面具有巨大的应用潜力。
公司博士研究生郑毅和副研究员刘洋为论文第一作者,丁明明教授为论文通讯作者。该研究工作得到了国家自然科学基金委、四川省科技厅和高分子材料工程国家重点实验室项目资助。
论文链接:https://doi.org/10.1002/adma.202210986
撰稿:郑毅
编辑:杨燕玲
审核:刘向阳